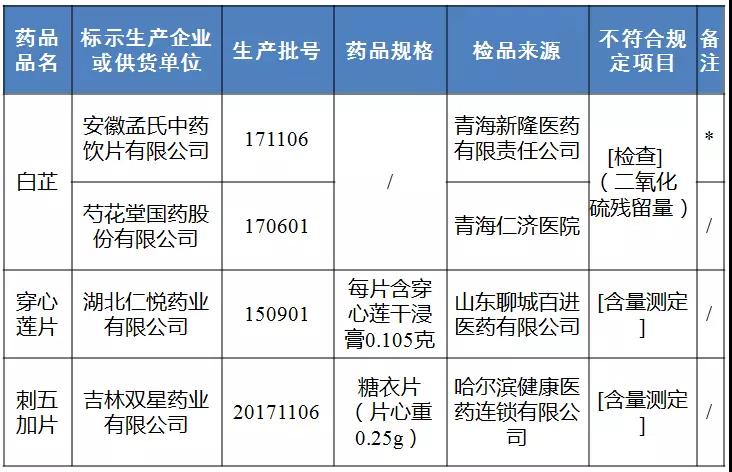
5月16日,国家药品监督管理局官网发布通告称,经甘肃省药品检验研究院等3家药品检验机构检验,标示为芍花堂国药股份有限公司等4家企业生产的4批次药品不符合规定。详情如下:
经甘肃省药品检验研究院检验,标示为芍花堂国药股份有限公司等2家企业生产的2批次白芷不符合规定,不符合规定项目为二氧化硫残留量。
经河北省药品检验研究院检验,标示为湖北仁悦药业有限公司生产的1批次穿心莲片不符合规定,不符合规定项目为含量测定。
经青海省药品检验检测院检验,标示为吉林双星药业有限公司生产的1批次刺五加片不符合规定,不符合规定项目为含量测定。
4批次不符合规定药品名单
备注:标“*”的药品为标示生产企业否认为该企业生产。
对上述不符合规定药品,相关药品监督管理部门已采取查封、扣押等控制措施,要求企业暂停销售使用、召回产品,并进行整改。
国家药品监督管理局要求相关省级药品监督管理部门对上述企业和单位依据《中华人民共和国药品管理法》第七十三、七十四、七十五条等规定对生产销售假劣药品的违法行为进行立案调查,自收到检验报告书之日起3个月内完成对相关企业或单位的调查处理并公开处理结果。
在立案调查工作中,企业对产品真实性有异议的,可以向所在地省级药品监督管理部门提出。标示生产企业所在地省级药品监督管理部门应对该企业的生产销售情况进行调查核实,被抽样单位所在地省级药品监督管理部门应追溯问题产品来源;两地药品监督管理部门要相互配合、及时通报、一查到底,并将相关工作情况按要求及时上报。(来源:国家药品监督管理局官网)